2012年一級注冊結(jié)構(gòu)工程師考試普通化學(xué)考前沖刺(九)
發(fā)布時(shí)間:2012-07-25 共1頁
考前沖刺(九)
| 一、單選題 |
1.已知在298K時(shí)的標(biāo)準(zhǔn)條件下,反應(yīng)MnO +4H +4H.gif) +2Clˉ=Mn +2Clˉ=Mn +Cl +Cl +2H +2H O反向自發(fā)進(jìn)行,則下列敘述中正確的是( )。 O反向自發(fā)進(jìn)行,則下列敘述中正確的是( )。 |
正確答案:C 解題思路:題目所給反應(yīng)在298K時(shí)的標(biāo)準(zhǔn)條件下反向自發(fā)進(jìn)行時(shí),正極是氯電極,負(fù)極是二氧化錳電極。因此,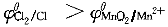 ,Cl ,Cl 是氧化劑,Mn 是氧化劑,Mn.gif) 是還原劑。選項(xiàng)A和B是錯(cuò)誤的;增加氫離子濃度,會使該反應(yīng)正向進(jìn)行的趨勢增大,但不會改變反應(yīng)的平衡常數(shù)。故D也是錯(cuò)誤的;正確答案是C。 是還原劑。選項(xiàng)A和B是錯(cuò)誤的;增加氫離子濃度,會使該反應(yīng)正向進(jìn)行的趨勢增大,但不會改變反應(yīng)的平衡常數(shù)。故D也是錯(cuò)誤的;正確答案是C。 |
|
|
| 2.在恒定大氣壓力下,將1mol的氦氣與1mol的水蒸氣封閉在一個(gè)體積可變的容器中,并把溫度從400K降低到300K,則降溫前與降溫后氣體的體積比是(忽略水的體積及其蒸汽壓)( )。 |
正確答案:B 解題思路:降溫前:H O是氣體,pV O是氣體,pV.gif) =(1+1)×R×400;降溫后:H =(1+1)×R×400;降溫后:H O是液體pV O是液體pV =1×R×300;用前式比后式即可得出結(jié)論。該題的要點(diǎn)是兩個(gè):一是大氣壓力恒定不變;二是400K時(shí)H =1×R×300;用前式比后式即可得出結(jié)論。該題的要點(diǎn)是兩個(gè):一是大氣壓力恒定不變;二是400K時(shí)H O是氣體,300K時(shí)H O是氣體,300K時(shí)H.gif) O是液體;B是正確答案。 O是液體;B是正確答案。 |
|
|
| 3.等體積、等濃度的氨水和鹽酸溶液混合均勻后,混合溶液中各離子平衡濃度由大到小的正確順序是( )。 |
正確答案:C 解題思路:等體積、等濃度的氨水和鹽酸溶液混合均勻后,相當(dāng)于是NH.gif) Cl的水溶液,其中銨根離子和氯離子的分析濃度相等,由于氯離子是強(qiáng)酸酸根,不會水解,而銨根離子是一個(gè)弱酸,會發(fā)生少量離解,產(chǎn)生少量的氫離子。所以C是正確答案。 Cl的水溶液,其中銨根離子和氯離子的分析濃度相等,由于氯離子是強(qiáng)酸酸根,不會水解,而銨根離子是一個(gè)弱酸,會發(fā)生少量離解,產(chǎn)生少量的氫離子。所以C是正確答案。 |
|
|
4.在原電池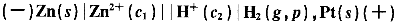 中有兩個(gè)電極,下述電極符號中錯(cuò)誤的是i( )。 中有兩個(gè)電極,下述電極符號中錯(cuò)誤的是i( )。 |
| 正確答案:B 解題思路:在書寫電極符號時(shí),相界面兩側(cè)的物質(zhì)可以隨意互換,因此選項(xiàng)A是正確的負(fù)極電極符號;選項(xiàng)D是正確的正極電極符號;有時(shí)相界面可以用","和"|"互換,選項(xiàng)C也是正確的正極電極符號,選項(xiàng)B中氫氣和氫離子的相界面是不能夠用","代替"|"的,因?yàn)閮烧叩淖饔檬敲黠@不同的,故選項(xiàng)B是一個(gè)錯(cuò)誤的正極電極符號,也就是正確答案。 |
|
|
| 5.某吸熱反應(yīng)正反應(yīng)的活化能是30kl/mol,則其逆反應(yīng)的活化能( )。 |
| 正確答案:A 解題思路:因活化能是反應(yīng)過渡態(tài)的能量與反應(yīng)物平均能量的差,反應(yīng)的熱效應(yīng)是產(chǎn)物的平均能量與反應(yīng)物的平均能量的差,故吸熱反應(yīng)產(chǎn)物的平均能量高于反應(yīng)物的平均能量。逆反應(yīng)的活化能就是反應(yīng)過渡態(tài)的能量與產(chǎn)物平均能量的差,因此,吸熱反應(yīng)逆反應(yīng)的活化能會小于正反應(yīng)的活化能,即A是正確答案。 |
- 蒸汽采暖系統(tǒng)宜采用哪種散熱器
- 哪種民用建筑的采暖散熱器必須暗裝或加防護(hù)罩
- 設(shè)置全面采暖的建筑物,其圍護(hù)結(jié)構(gòu)的傳熱阻
- 空氣調(diào)節(jié)系統(tǒng)的送風(fēng)量,應(yīng)按什么確定
- 空調(diào)系統(tǒng)的新風(fēng)量,無須保證哪一條
- 對于風(fēng)機(jī)盤管的水系統(tǒng),哪種調(diào)節(jié)方式為變流量水系統(tǒng)
- 構(gòu)件正常工作時(shí)應(yīng)滿足的條件是指什么
- 剪應(yīng)力互等定理只適用于哪里
- 2014年結(jié)構(gòu)工程師基礎(chǔ)知識選擇題練習(xí)及解析3
- 2014年結(jié)構(gòu)工程師基礎(chǔ)知識選擇題練習(xí)及解析2_第2頁
- 2013年一級注冊結(jié)構(gòu)工程師考試基礎(chǔ)題及答案1
- [結(jié)構(gòu)工程師]結(jié)構(gòu)力學(xué)幾何組成分析例題-5
- 2013年一級注冊結(jié)構(gòu)工程師考試基礎(chǔ)題及答案2
- 2013年一級注冊結(jié)構(gòu)工程師考試基礎(chǔ)題及答案3
- [結(jié)構(gòu)工程師]結(jié)構(gòu)力學(xué)幾何組成分析例題-7
- 2012年一級注冊結(jié)構(gòu)工程師考試?yán)碚摿W(xué)考前沖刺(十)
- 2012年一級注冊結(jié)構(gòu)工程師考試普通物理考前沖刺(十)
- 2013年二級結(jié)構(gòu)工程師考試混凝土結(jié)構(gòu)設(shè)計(jì)習(xí)題三
- 2012年一級注冊結(jié)構(gòu)工程師考試普通物理考前沖刺(四)
- 2012年一級注冊結(jié)構(gòu)工程師考試流體力學(xué)考前沖刺(八)

