粗面內質網的功能――蛋白質轉運[細胞生物學]
發布時間:2011-10-18 共1頁
粗面內質網的功能――蛋白質轉運
粗面內質網的主要功能是幫助膜結合核糖體合成的蛋白質轉運。膜結合核糖體上合成的蛋白質與游離核糖體上合成的蛋白質去向是不同的,表9-5列出了這兩類核糖體合成的某些蛋白。
表9-5 真核細胞中膜結合核糖體和游離核糖體合成的某些蛋白
| 膜結合核糖體 | 游離核糖體 |
| 分泌蛋白 | 可溶性胞質溶膠蛋白 |
| 肽類激素 | 脂錨定膜蛋白 |
| 生長因子 | (位于質膜的胞質面) |
| 消化酶類 | 外周蛋白 |
| 血清蛋白 | (質膜的胞質面) |
| 細胞外基質蛋白 | 核基因編碼的線粒體蛋白 |
| 釋放到ER腔中的蛋白 | 核基因編碼的葉綠體蛋白 |
| RER中的酶類 | 過氧化物酶體蛋白 |
| 高爾基復合體的酶 | 核蛋白 |
| 溶酶體的酶 | |
| 整合膜蛋白 | |
| ER膜的糖蛋白 | |
| 高爾基體的膜糖蛋白 | |
| 溶酶體膜糖蛋白 | |
| 質膜糖蛋白 | |
| 核膜糖蛋白 | |
| 脂錨定質膜蛋白 | |
| 質膜的外周蛋白(位于質膜的外側面) |
由于粗面內質網上合成的蛋白質包括膜蛋白、內膜結構的腔池蛋白和分泌到細胞外的蛋白, 所以必須有極好的運輸機制進行分選定位, 這就是信號肽假說。
■ 信號序列的發現和證實
● 微粒體實驗
在George Palade用離心技術分離到有核糖體結合的微粒體,即發現膜結合核糖體(membrane-bounded ribosome)之后, 科學家推測:膜結合核糖體合成的蛋白質首先要進入內質網的腔,然后通過選擇性的分泌過程輸出到細胞外,而游離核糖體上合成的蛋白質則留在細胞內使用。
為了研究內質網上合成的蛋白質是否進入了內質網的腔, Colvin Redman 和 David Sabatini用分離的RER小泡(微粒體)進行無細胞系統的蛋白質合成, 證明了膜結合核糖體上合成的蛋白質進入了微粒體的腔。
如何利用微粒體在無細胞蛋白質合成系統中的合成實驗證明膜結合核糖體合成的蛋白質進入了微粒體的腔
● Günter Blobel等的建議
為什么有些核糖體合成蛋白質時不同內質網結合,有些正在合成蛋白質的核糖體要同內質網結合,并將合成的蛋白質插入內質網?對此,美國洛克菲勒大學的 Günter Blobel、David Sabatini 和Bernhard Dobberstein 等于1971年提出兩點建議:
①分泌蛋白的N-端含有一段特別的信號序列(signal sequence),可將多肽和核糖體引導到ER膜上;②多肽通過ER膜上的水性通道進入ER的腔中,并推測多肽是在合成的同時轉移的。
● 信號序列存在的直接證據
1972年,César Milstein和他的同事用無細胞系統研究免疫球蛋白(IgG)輕鏈合成時獲得了信號序列存在的直接證據, 證明Blobel等的建議是正確的。他們用分離純化的核糖體在無細胞體系中用編碼免疫球蛋白輕鏈的mRNA指導合成多肽,發現合成的多肽比分泌到細胞外的成熟的免疫球蛋白在N端有一段多出的肽鏈, 它有20個氨基酸,他們推測,這段肽具有信號作用,使IgG得以通過粗面內質網并繼而分泌到細胞外。
● 信號序列的進一步證實
G.Blobel、B.Dobberstein、P.Walter和他們的同事在上述發現的基礎上用分離的微粒體和無細胞體系進行了大量的實驗,進一步證實了信號序列的存在及其作用。
加與不加RER小泡,產物不同 當將分泌蛋白的mRNA在無細胞體系中進行翻譯時, 如果不加粗面內質網(微粒體), 獲得的翻譯產物比從細胞中分泌出來的蛋白要長,若添加RER小泡,翻譯的產物長度與從活細胞分泌的蛋白相同。因此推測信號序列在引導蛋白進入內質網后被切除了,所以成熟的蛋白的N-端沒有信號序列(圖9-16)。

圖9-16 信號序列在分泌蛋白質運輸中的作用
(a) 在不含RER小泡的無細胞體系中翻譯分泌蛋白,其N-端有信號序列,故比從細胞中分泌出來的相同蛋白質肽鏈長;(b)在加有RER小泡的無細胞體系中翻譯分泌蛋白,信號序列在RER小泡中被切除,得到的產物與從細胞中合成分泌的相同。
蛋白水解酶水解實驗 在分泌蛋白進行體外翻譯的無細胞系統中(含有RER小泡)加入蛋白水解酶,并不能使新生肽水解。但同時加入去垢劑,則能將蛋白質水解,提示新生肽鏈是邊合成邊運輸的,因為去垢劑能夠破壞內質網的膜,使合成的蛋白質暴露于蛋白水解酶遭到降解。若無去垢劑,多肽在合成的同時就向內質網轉運,所以不受蛋白水解酶的影響。
多聚核糖體的離體翻譯
從骨髓瘤分離多聚核糖體,用去垢劑處理,使之與內質網膜分離后,繼續在無細胞體系(不含RER小泡)中進行翻譯,發現:短時間溫育,即可得到成熟的分泌蛋白(無信號序列),而長時間的溫育,得到的產物N-端有信號序列,這一結果證明了信號序列的功能。
為什么說多聚核糖體是研究內質網幫助蛋白質運輸的好材料?
■ 信號序列的一般特征及早期信號假說
● 信號序列的一般特征
G.Blobel、B.Dobberstein、P.Walter和他們的同事在研究中還發現信號序列具有一些共同的特性:長度一般為15~35個氨基酸殘基, N-末端含有1個或多個帶正電荷的氨基酸,其后是6~12個連續的疏水殘基;在蛋白質合成中將核糖體引導到內質網,進入內質網后通常被切除(圖9-17)。

圖9-17 ER跨膜可切除信號的一般結構
● 早期的信號假說
1975年, G.Blobel和 B.Dobberstein 根據對信號序列的研究成果,正式提出了信號假說(signal hypothesis),要點是:
(1)分泌蛋白的合成始于細胞質中的游離核糖體;
(2)合成的N-端信號序列露出核糖體后,靠自由碰撞與內質網膜接觸,然后靠N-端信號序列的疏水性插入內質網的膜;
(3)蛋白質繼續合成,并以袢環形式穿過內質網的膜;
(4)如果合成的是分泌的蛋白,除了信號序列被信號肽酶切除外,全部進入內質網的腔,若是膜蛋白,則由一個或多個停止轉移信號將蛋白質錨定在內質網膜上。
● 信號假說證明: 基因重組實驗
信號假說提出后得到許多實驗的支持,其中最有力的一項實驗結果是雜合蛋白研究的結果。黑猩猩的α-球蛋白是一種在游離核糖體上合成并存在于胞質溶膠中的可溶性蛋白,科學家在編碼該蛋白的基因上接上一段編碼E.coli分泌蛋白β-半乳糖透性酶(β-lactamase)的信號序列DNA, 然后將該基因加入到無細胞的轉錄和翻譯體系中,并加入從狗組織中分離的ER膜,研究結果發現,雜合蛋白出現在ER腔中,而且信號序列被切除了。這一研究結果不僅證實了信號假說的正確性,也揭示了信號序列的一個重要特性:信號序列沒有特異性,并且原核生物的信號序列在真核生物中也是有效的。
● Blobel 于1972年提出信號序列的建議、1975年正式提出信號假說,揭示了細胞中不同蛋白質在合成后是如何找到自己的工作崗位的秘密,發現了蛋白質與生具來的“地址簽”。這一發現開辟了一個全新的醫學、細胞生物學和生物技術學的研究領域,基于他的貢獻,使他獲得了1999年諾貝爾醫學獎。
■ 新蛋白復合物的發現與信號假說的補充
● 信號識別顆粒(signal recognition partical, SRP)
1981年,發現了信號識別顆粒(signal recognition partical, SRP),是一種核糖核酸蛋白復合體,沉降系數為11S,含有分子量為72kd、68kDa、54kDa、19kDa、14kDa及9kDa的6條多肽和一個7S(長約300個核苷酸)的scRNA(圖9-18), 它的作用是識別信號序列,并將核糖體引導到內質網上。

圖9-18 信號識別顆粒(SRP)的組成
● 停靠蛋白 (docking protein, DP)
即SRP在內質網膜上的受體蛋白,它能夠與結合有信號序列的SRP牢牢地結合,使正在合成蛋白質的核糖體停靠到內質網上來。
■ 蛋白質共翻譯轉運的機理:信號假說
● 新信號假說的基本內容
補充修改后的信號假說比早期的信號假說更為合理, 這一假說的核心內容是: 核糖體同內質網的結合受制于mRNA中特定的密碼序列(可以翻譯成信號肽),具有這種密碼序列的新生肽才能連同核糖體一起附著到內質網膜的特定部位。因此,核糖體同內質網的結合是功能性結合,具有功能性和暫時性,并受時間和空間的限制。正是由于這種結合保證了新合成蛋白的矢量釋放。信號序列的兩個基本作用是:①通過與SRP的識別和結合, 引導核糖體與內質網結合; ②通過信號序列的疏水性,引導新生肽跨膜轉運。圖9-19是修改后的信號假說的主要內容。

圖9-19膜結合核糖體體的蛋白質合成與轉運
● SRP、SRP受體功能的離體鑒定
任何假說都要經受得起實驗的檢驗。假說中的SRP、SRP受體的功能都已有體外實驗的證明。
請你設計一個離體實驗證明SRP和SRP受體的功能。
● 信號肽跨膜的能量來源
研究證明SRP受體和SRP都是G蛋白,它們不僅將合成蛋白質的核糖體引導到內質網, 而且通過GTP-GDP的交換, 將內質網膜中的易位子(translocon)通道打開, 讓信號序列與之結合(圖9-20)。GTP 水解作為信號序列轉運的能量來源。

■ 膜蛋白的共翻譯轉運機理
在粗面內質網上合成的蛋白質有兩類:分泌蛋白和膜蛋白,膜蛋白的共翻譯轉運較為復雜,首先它要靠疏水區滯留在內質網上,另外膜蛋白分單次跨膜和多次跨膜;還有膜蛋白在膜上的定向問題,即羧基端和氨基端位于內質網膜的內側(內質網腔面)還是外側(胞質溶膠一側),還是位于同一側。
● 起始轉移信號(start-transfer signal)
蛋白質氨基末端的信號序列除了作為信號被SRP識別外, 還具有起始穿膜轉移的作用。在蛋白質共翻譯轉運過程中,信號序列的N-端始終朝向內質網的外側,插入蛋白質轉運通道后與通道內的信號序列結合位點(受體)結合,其后的肽序列是以袢環的形式通過運輸通道。[]
● 內含信號序列(internal signal sequence) 與單次跨膜蛋白
內含信號序列又稱內含信號肽(internal signal peptides),它不位于N-末端,但具信號序列的作用,故稱為內含信號序列。它可作為蛋白質共翻譯轉移的信號被SRP識別,同時它也是起始轉移信號。由于內含信號序列是不可切除的,又是疏水性,所以它是膜蛋白的一部分,如果共翻譯轉運蛋白質中只有一個內含信號序列,那么合成的蛋白就是單次跨膜蛋白(圖9-21)。

圖9-21 內含信號序列與單次跨膜蛋白的整合
內含信號序列首先作為信號序列與SRP一起將核糖體附著到內質網,然后作為起始轉移信號與蛋白質轉運通道結合引導新生肽的轉移。在與轉運通道結合過程中,始終保持具有較多正電荷氨基酸的一端朝向胞質溶膠一側,由于它不能被切除,所以合成的是膜蛋白。(a) 內含信號序列作為起始轉移信號,在保持信號序列中具有較多正電荷氨基酸一端朝向胞質溶膠面的情況下與羧基端的臂形成環,插入到轉運通道中。(b)作用方式與(a)相同,只是內含信號序列中含較多正電荷一端與氨基端相反,所以要進行調整,在跨膜時保持正電荷一端朝向胞質溶膠面。
● 停止轉移肽(stop-transfer peptide)與單次跨膜蛋白
單次跨膜蛋白的形成除了與含有內含信號序列有關外,終止轉移肽也與單次跨膜蛋白的形成相關。
因停止轉移信號的作用而形成單次跨膜的蛋白,那么該蛋白在結構上只有一個停止轉移信號序列,沒有內含轉移信號,但在N-端有一個信號序列作為轉移起始信號(圖9-22)。

圖9-22 終止轉移信號與單次跨膜蛋白的形成
該蛋白在N-末端信號序列的作用下進行共翻譯轉運,當停止轉移信號進入通道后,與通道內的結合位點相互作用,使通道轉運蛋白失活,從而停止蛋白質的轉運。由于N-末端的信號序列是可切除的,信號序列被切除后形成單次跨膜蛋白。
二次跨膜蛋白與多次跨膜蛋白
所謂二次跨膜就是在蛋白質中有兩個跨膜的疏水區,多次跨膜則有多個起始跨膜信號與多個停止轉移信號,它們的形成與內含信號序列和終止轉移信號相關。
如果是二次跨膜,則含有一個內含信號序列和一個停止轉移信號(圖9-23)。

圖9-23 二次跨膜蛋白的形成
內含信號序列形成一個跨膜區,停止轉移序列形成一個跨膜區,二者相加就成為二次跨膜蛋白。
在了解了二次跨膜形成的方式之后,不難推測多次跨膜蛋白的形成一定含有多個內含信號序列和多個停止轉移信號。
根據信號假說, 膜蛋白(單次和多次跨膜)是怎樣形成的?
■ Bip在ER蛋白的轉移和裝配中的作用
研究發現進入內質網腔中的蛋白質片段很快被一些稱為Bip的蛋白結合。
Bip蛋白是重鏈結合蛋白 (heavy-chain binding protein) 的簡稱,因為它能夠同IgG抗體的重鏈結合。Bip是一類分子伴侶,屬于Hsp70家族,在內質網中有兩個作用。
●Bip同進入內質網的未折疊蛋白質的疏水氨基酸結合,防止多肽鏈不正確地折疊和聚合(圖9-24)。
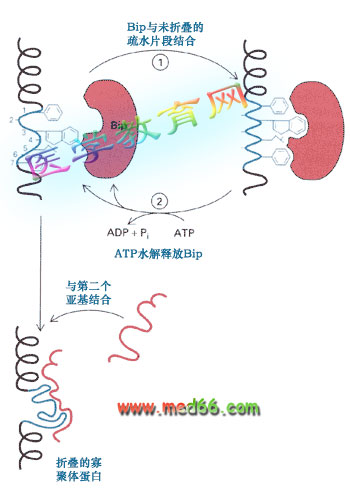
圖9-24 Bip在ER腔中的作用
Bip與轉運到ER中蛋白的疏水部分結合,防止蛋白質的變性或降解,使其正確地折疊。結合有蛋白質的Bip在ATP水解后釋放被結合的蛋白,如果釋放的蛋白仍然是未折疊的,Bip將重新與這種蛋白結合。Bip還可幫助兩種不同的蛋白共同裝配。
● Bip的第二個作用是防止新合成的蛋白質在轉運過程中變性或斷裂。通過重組DNA技術,將酵母中編碼Bip蛋白的基因突變成溫度敏感型后,當提高細胞培養溫度時,Bip的功能就會喪失,蛋白質向ER的轉移也會停止,推測由于Bip功能的喪失,導致蛋白質在ER中的聚集,抑制了新生肽向ER的轉移。
■ 蛋白質在內質網中的修飾
新生肽進入ER腔之后除了要進行正確的折疊之外,還要經過各種不同的修飾之后才能運送到其它的部位。
● N-連接糖基化(N-linked glycosylation)
糖基化的第一步是將一個14糖的核心寡聚糖添加到新形成多肽鏈的天冬氨酸上,其氨基酸的特征序列是Asn-X-Ser/Thr(X代表任何一種氨基酸), 由于糖是同天冬酰胺的自由NH2連接,所以將這種糖基化稱為N-連接的糖基化(圖9-25)。

圖9-25 正在ER中合成蛋白質的N-連接糖基化
● 羥基化(hydroxylation)
除了N-連接糖基化以外,新生肽的脯氨酸和賴氨酸要進行羥基化,形成羥脯氨酸和羥賴氨酸,不過這種反應只是在少數蛋白上發生。在合成膠原的細胞中,脯氨酸和賴氨酸羥基化則是一個主要的反應。
● 形成脂錨定蛋白[]
新合成的蛋白質除了成為跨膜蛋白或ER腔中的游離蛋白外,還會通過酰基化同ER膜上的糖脂結合,將自己錨定在ER膜上。圖9-26是新合成的ER蛋白被信號肽酶從ER上切割之后,立即通過羧基端與已存在于ER膜上的糖基磷脂酰肌醇共價結合,形成脂錨定蛋白的簡化過程。形成的脂錨定糖蛋白通過進一步的運輸成為質膜外側的膜蛋白。

圖9-26 蛋白質附著到糖基磷脂酰肌醇成為脂錨定蛋白
● 翻譯后跨ER膜運輸
某些蛋白質也可通過翻譯后跨ER膜運輸,由于這些蛋白的信號序列太短而無法與SRP相互作用, 它們主要是靠分子伴侶維持非折疊狀態進行跨膜轉運。關于翻譯后跨ER膜運輸的詳細機理還不太清楚。

